식약처, 2017년 상반기 제네릭의약품 개발동향 분석 발표
대전인터넷신문 2017-08-30 15:24:34
식약처, 2017년 상반기 제네릭의약품 개발동향 분석 발표
식품의약품안전처(처장 류영진) 식품의약품안전평가원은 `17년 상반기 제네릭의약품 허가를 위한 생물학적동등성 시험 계획 승인 건수는 70건으로 지난해 상반기(47건)에 대비 약 49% 증가했다고 밝혔다.
이는 올해 재심사(신약 등에 대해서 일정기간(허가일로부터 4∼6년)을 정하여 시판 후 약물사용에 따른 안전성·유효성에 관한 자료를 수집·평가하는 제도) 만료(`17.11.20.) 예정으로 시장성이 높은 당뇨병 관련 치료제 알티옥트산트로메타민염과 심혈관계 치료제 아픽사반 등의 개발이 활성화된데 따른 것으로 분석된다.
제네릭의약품 개발을 위해 승인된 생동성시험의 주요 특징은 ▲재심사 또는 특허 만료예정 의약품 개발 집중 ▲치료영역별로 대사성의약품, 중추신경계용의약품 개발 여전히 활발 등이다.
올해 상반기에 승인된 70건 중 재심사나 특허 만료 예정 품목 에 대한 제네릭의약품 생동성 승인은 40건(57.1%)을 차지했다.
재심사·특허 만료 예정 품목 중 고령화, 식이변화 등의 영향으로 당뇨병 관련 치료제(23건), 심혈관계 치료제(6건)와 같은 만성질환 치료제가 높은 비중(29건 72.5%)을 차지했다.
`16년에 이어 재심사 만료예정 의약품인 당뇨병치료제 리나글립틴/메트포르민 복합제(`17.9)와 특허 만료예정 의약품인 비염치료제 베포타스틴베실산염(`17.12)에 대한 제네릭의약품도 꾸준히 개발되고 있는 것으로 나타났다.
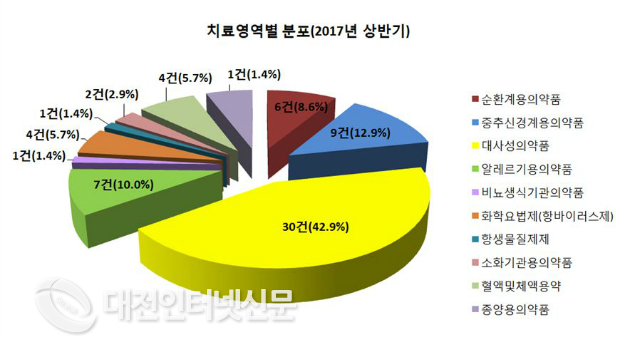
`17년 상반기 치료영역별 승인건수는 당뇨병치료제 등 대사성의약품(30건, 42.9%), 우울증 등에 사용하는 중추신경계용의약품(9건, 12.9%)의 개발 건수가 전체의 절반 이상(39건, 55.8%)을 차지하였으며, 알레르기용의약품(7건, 10.0%), 순환계용의약품(6건, 8.6%) 등이 뒤를 이었다.
대사성의약품으로는 당뇨병성 다발성 신경염의 완화에 사용되는 알티옥트산트로메타민염(13건) 당뇨병치료제인 리나글립틴/메트포르민염산염(5건) 개발이 집중되었다.
중추신경계의약품은 고령화와 스트레스 등의 영향으로 매년 꾸준히 개발이 이루어지고 있으며, 우울증 치료제 미르타자핀, 쿠에티아핀푸마르산염과 파킨슨병 치료제인 로피니롤염산염이 각각 2건 승인되었다.
식약처는 앞으로도 만성질환 치료제 개발 및 재심사나 특허만료 예정 의약품 개발이 꾸준히 이루어질 것으로 전망된다며, 제네릭의약품 국제 규제 조화 등을 통해 우수한 제네릭의약품 개발을 촉진하고 품질을 향상시킬 수 있도록 노력하겠다고 밝혔다.
생동성 승인 현황은 [온라인의약도서관 http://drug.mfds.go.kr → 의약전문가 → 생동성주간승인정보]에서 확인할 수 있다.
<무단전재 및 재배포 금지> 최 대열 기자
| |
| ▲ 치료영역별 분포(2017년 상반기)출처-식약처 |